- EAU - Physico-chimie
- EAU - Physico-chimieComposé chimique de formule H2O, l’eau est la substance la plus abondante à la surface du globe. On la rencontre sous les trois états de la matière. Bien connue sous la forme de glace ou de neige, l’eau solide est également présente dans d’innombrables minéraux, les hydrates naturels. Les eaux naturelles sont des mélanges, l’oxyde d’hydrogène étant souillé par des impuretés minérales ou organiques. La vapeur d’eau est un important constituant de l’atmosphère. Bien que très étudiées, les propriétés physico-chimiques de l’eau sont encore mal connues. Liquide aux propriétés thermodynamiques anormales, c’est cependant l’eau qui est, encore aujourd’hui, l’élément de référence dans la définition de l’échelle thermométrique Celsius. Ces propriétés anormales ont déterminé la nature de notre monde physique et biologique.1. Eaux naturelles et purifiéesÀ l’état liquide, l’eau constitue de 50 à 75 p. 100 du poids des végétaux, 70 p. 100 du poids du corps humain. Intimement intégrée dans des groupes fonctionnels, elle apparaît dans la dégradation de certaines substances comme les sucres. L’eau naturelle est en général souillée par des impuretés minérales et organiques, et pratiquement toujours par des gaz dissous (air et dioxyde de carbone CO2). Un litre d’eau à 20 0C dissout 19 millilitres d’air. Celui-ci s’y enrichit en oxygène (de 20,9 à 34 p. 100 en volume). L’eau de montagne contient surtout des produits minéraux mais peut être très pure. L’eau des plaines contient peu de dioxyde de carbone; moins minéralisée, elle est souvent polluée par des substances organiques (albuminoïdes) qui s’y dégradent et par des micro-organismes. Les mers bordières, épicontinentales et intracontinentales contiennent de 4 à 42 grammes de sels par litre d’eau. La salinité moyenne de l’océan mondial est de l’ordre de 35 grammes par litre.La qualité d’une eau est caractérisée par sa dureté rapportée à la teneur en carbonate de calcium. À ce critère, on préfère souvent une étude complète de la composition ionique.On traite les eaux naturelles en vue de l’obtention d’eaux potables et d’eaux à usage industriel ou agricole. L’eau potable peut contenir jusqu’à 600 milligrammes de sels par litre. L’eau des chaudières doit être de faible dureté. La méthode la plus efficace de désionisation est l’échange d’ions. La distillation en récipient de silice et à l’abri de l’air (absence de dioxyde de carbone) conduit à l’eau la plus pure, dite eau de conductivité .2. Propriété physiquesPropriétés thermodynamiquesLes températures de la glace fondante et de la vapeur condensante sous la pression atmosphérique normale de 1 013,25 hPa définissent le 0 et le 100 de l’échelle Celsius.La glace existe au moins sous dix formes cristallines. Le point triple (point d’intersections des courbes d’évaporation, de sublimation et de fusion) de la glace ordinaire (glace Ih) est point fixe de l’échelle internationale des températures.L’eau présente certaines anomalies: elle se contracte à la fusion et a une densité maximale à 3,98 0C. Au-delà, son coefficient de dilatation est important. Sa compressibilité est faible. Son enthalpie de vaporisation donne une constante de Trouton anormale, voisine de 26. (Cette constante, quotient de la chaleur molaire de vaporisation par la température absolue d’ébullition, est l’entropie molaire de vaporisation. Elle est de 21 pour la plupart des substances.)Sa chaleur spécifique entre 14,5 et 15,5 0C a servi à définir la calorie, qui est la quantité de chaleur nécessaire pour faire parcourir un tel échauffement à un gramme d’eau. Elle décroît au-delà et passe par un minimum au voisinage de 35 0C.Autres propriétés physiquesLa viscosité de l’eau est relativement faible, sa conductibilité thermique est quinze fois plus petite que celle du mercure. C’est un liquide très mouillant vis-à-vis du verre, qu’il recouvre parfaitement d’une mince pellicule avec un angle de raccordement pratiquement nul (cf. phénomènes de SURFACE).L’eau liquide est transparente sous faible épaisseur, bleue sous grande épaisseur. Opaque dans l’infrarouge, c’est un filtre calorifique. Sous 1 centimètre, elle absorbe toutes les longueurs d’onde supérieures à 1,4 猪m.Son absorption dans l’ultraviolet est importante vers 186 nanomètres.Sa constante diélectrique est l’une des plus élevées. La conductivité électrique de l’eau ultra-purifiée est très faible.3. Propriétés chimiquesL’eau est un réactif très important dans l’état gazeux et surtout dans l’état liquide. C’est un composé très stable avec, pour sa réaction de formation à 25 0C:
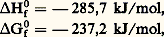 ce qui conduit à une vapeur d’eau très peu dissociée, même à température élevée (2 p. 100 à 2 000 0C, 60 p. 100 à 3 000 0C).Caractère acide et basiqueL’eau se combine aux oxydes pour donner des hydroxoacides, des hydroxobases et des hydroxydes amphotères suivant la position de l’oxyde dans la classification périodique et son degré d’oxydation:
ce qui conduit à une vapeur d’eau très peu dissociée, même à température élevée (2 p. 100 à 2 000 0C, 60 p. 100 à 3 000 0C).Caractère acide et basiqueL’eau se combine aux oxydes pour donner des hydroxoacides, des hydroxobases et des hydroxydes amphotères suivant la position de l’oxyde dans la classification périodique et son degré d’oxydation: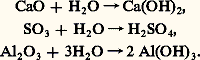 Cette dernière réaction est d’ailleurs très complexe. L’eau s’ionise suivant l’équilibre:
Cette dernière réaction est d’ailleurs très complexe. L’eau s’ionise suivant l’équilibre: ( H0 = 漣 55,9 kJ/mol), auquel correspond à 25 0C une constante d’équilibre K = 3,2.10-18 qui conduit pour l’eau pure aux concentrations:
( H0 = 漣 55,9 kJ/mol), auquel correspond à 25 0C une constante d’équilibre K = 3,2.10-18 qui conduit pour l’eau pure aux concentrations: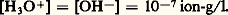 Cela permet de rendre compte des réactions de neutralisation et du phénomène d’hydrolyse (hydrolyse du carbonate de sodium aussi bien que du chlorure d’aluminium).Caractère oxydoréducteurLe sodium réduit l’eau à température ambiante avec inflammation:
Cela permet de rendre compte des réactions de neutralisation et du phénomène d’hydrolyse (hydrolyse du carbonate de sodium aussi bien que du chlorure d’aluminium).Caractère oxydoréducteurLe sodium réduit l’eau à température ambiante avec inflammation: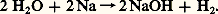 Le fluor l’oxyde:
Le fluor l’oxyde: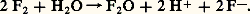 La vapeur d’eau est un oxydant vis-à-vis de nombreux métaux et non-métaux:
La vapeur d’eau est un oxydant vis-à-vis de nombreux métaux et non-métaux: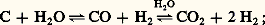 elle réduit le chlore:
elle réduit le chlore: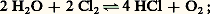 elle est aussi un dismutant du soufre:
elle est aussi un dismutant du soufre: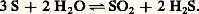 Les propriétés oxydantes et réductrices de l’eau liquide sont expliquées par les deux demi-réactions:
Les propriétés oxydantes et réductrices de l’eau liquide sont expliquées par les deux demi-réactions: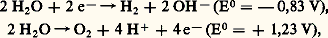 Le diagramme potentiel-pH rend compte à la fois de la réactivité et de l’électrolyse de l’eau (fig. 1). Les réducteurs de l’eau ont un potentiel de réduction situé dans la zone inférieure (E0Na/Na+ = 漣 2,71 V). Ses oxydants sont situés dans la zone supérieure (E0F-/F = + 1,9 V). Il faut une différence de potentiel entre électrodes supérieure à 1,23 V pour électrolyser l’eau.4. Structure du liquideLa molécule d’eau est une petite molécule angulaire et symétrique, mais son moment dipolaire élevé (1,85 debye) ne peut être expliqué que par l’existence de deux paires d’électrons libres. Les deux paires et les deux liaisons sont orientées tétraédriquement, comme dans la glace Ih (fig. 2), dans laquelle il y a des liaisons hydrogène (liaisons H) O 漣H...O résultant de l’interaction entre l’hydrogène d’une liaison O 漣H d’une première molécule d’eau et une paire d’électrons libre d’un oxygène d’une autre molécule d’eau.Dès 1933, J. D. Bernal et R. H. Fowler ont proposé un modèle de l’eau liquide fondé sur celui de la glace. Le squelette glace se rompt partiellement en libérant de l’eau monomère dont la proportion croît avec la température. Mais, en 1965, Stevenson a montré que la proportion de monomère était très faible (inférieure à 5 p. 1000 à 25 0C). Cela a conduit H. Eyring à proposer un modèle où des essaims de 48 molécules d’eau ayant la densité de la glace Ih sont dispersés dans un solvant de structure quasi cristalline (densité de la glace III). En fondant, la glace Ih se transforme en liquide quasi cristallin III où apparaissent des lacunes fluctuantes et il y a contraction. Le volume décroît encore à température croissante jusqu’à 3,98 0C, où les derniers essaims du type Ih ont disparu. Au-delà, il y a dilatation normale. Ces concepts introduits dans la théorie des liquides d’Eyring permettent de calculer toutes les fonctions thermodynamiques de l’eau et de l’eau lourde et même les viscosités. L’accord avec l’expérience est excellent.Une théorie différente, fondée sur la notion de squelette à liaisons H distordues mais non rompues, rend compte de la constante diélectrique (J. A. Pople).5. L’eau en tant que solvantL’eau, polaire et de grande constante diélectrique, mauvais solvant des composés non polaires (hydrocarbures), est un bon solvant des composés à liaisons H et des électrolytes.Les solutés non polaires comme l’air, le méthane et l’éthylène sont environ dix mille fois moins solubles que l’ammoniac. Ces composés renforcent la structure cristalline de l’eau par formation d’«icebergs» autour du soluté; l’entropie diminue, ainsi que la solubilité.La solubilité des solutés donnant des liaisons H varie avec le poids relatif de la partie non polaire: l’éthanol est entièrement soluble alors que le butanol ne l’est que partiellement ainsi que le phénol, l’éther et la triméthylamine.La solubilité des protéines et des lipides dans l’eau est faible. La solubilité de l’eau dans ces composés l’est aussi du fait de la compétition entre les liaisons hydrogène, les liaisons molécule-molécule et les liaisons molécule-eau. Les groupes peptidiques peuvent se lier à quatre molécules d’eau, mais il y a encore compétition. On peut comparer à cela le gonflement des résines échangeuses d’ions. Les gels seraient dus à l’adsorption de l’eau à la surface des colloïdes.Les sels, solutés ioniques, ont des solubilités très variées: 360 grammes par kilogramme d’eau pour le chlorure de sodium, 110 grammes pour le sulfate de potassium et seulement 0,7.10-3 g pour le sulfure de zinc. Les ions tels que La3+, Mg2+, H+, OH- et - («formateurs de structures», analogie avec la formation d’«icebergs») servent de noyaux pour la formation d’essaims; il y a accroissement de l’ordre dans l’eau. Les ions comme K+, Na+, Cl4-, I-, 3-, qui sont hydratés par une seule couche de molécules d’eau, inhibent la formation d’essaims: ce sont des «briseurs de structures» (Franck). La mesure de l’hydratation des ions montre que les premiers sont fortement hydratés. En solution diluée, H+ est tétrahydraté (ion H94+ de Eigen). Les solutions concentrées en acide contiennent l’ion H3+; l’ion H+ libre n’existe pas.6. Les hydrates cristallisésL’eau donne d’innombrables hydrates cristallisés à température ambiante que l’on peut diviser en hydrates à eau de coordination, hydrates supérieurs, hydrates de gaz et hydrates labiles.Hydrates de coordination et hydrates supérieursDans la bischofite MgCl2,6 H2O, les molécules d’eau s’orientent octaédriquement autour de l’ion Mg2+ par interaction ion-dipôle, pour former l’ion complexe [Mg(H2O)6]2+. Avec Ni2+, on obtient le même type d’ion, mais l’eau, par effet sur les électrons d de Ni2+, stabilise l’ion formé (effet de ligandes). Dans LiCl4,3 H2O (fig. 3), chaque ion Li+ est entouré d’un antiprisme de six molécules d’eau; il y a des files Li, 3 H2O, Li, 3 H2O et Cl4, Cl4,... parallèles. Dans les hydrates inférieurs, le cation est entouré partiellement d’eau et partiellement d’anions (CuCl2, 4 H2O). Dans les hydrates supérieurs, le cation est entièrement entouré d’eau et des molécules d’eau supplémentaires raccordent par liaisons H le cation hydraté aux anions (NiSO4, 7 H2O). Dans les hydrates d’acides forts, l’eau est coordinée au proton (ions H3+ et H52+ du monohydrate et du dihydrate de l’acide perchlorique). L’acide oxalique, faible, donne un dihydrate par liaisons hydrogène.Hydrates de gaz et anesthésieL’eau donne des hydrates avec les gaz argon, méthane, hémioxyde d’azote, dioxyde de carbone, etc. L’hydrate de chlore dit à 6 molécules d’eau qui en est le prototype est en réalité à 5,75 H2O. L’eau y prend une configuration spéciale et forme des cages qui piègent les petites molécules: 46 H2O groupées piègent 8 Cl2 ou 8 Ar, etc., 136 H2O groupées autrement piègent 16 molécules de chloroforme (hydrates à 17 H2O, fig. 3). Linus Pauling a expliqué l’action anesthésique de composés tels que l’oxyde nitreux, le dioxyde de carbone et le chloroforme ainsi que des gaz rares (agents non formateurs de liaisons H) par la cristallisation de leurs hydrates. Les microcristaux formés abaissent la conductivité électrique du réseau nerveux. Il y a diminution concomitante de l’énergie des oscillations électriques qui caractérisent l’état conscient et, de ce fait, perte de connaissance. C’est aussi de cette façon que l’on pourrait expliquer l’hibernation (formation de cristaux d’hydrates de gaz par diminution de la température).Hydrates labilesLes permutites et zéolites naturels ou artificiels, échangeurs d’ions minéraux et tamis moléculaires, forment des cages dans lesquelles l’eau est piégée. Ce sont des alumino-silicates. Le zéolite «A» Na12[(AlO2)12(SiO2)12] peut capter 27 H2O qu’il perd progressivement quand la température augmente.
Le diagramme potentiel-pH rend compte à la fois de la réactivité et de l’électrolyse de l’eau (fig. 1). Les réducteurs de l’eau ont un potentiel de réduction situé dans la zone inférieure (E0Na/Na+ = 漣 2,71 V). Ses oxydants sont situés dans la zone supérieure (E0F-/F = + 1,9 V). Il faut une différence de potentiel entre électrodes supérieure à 1,23 V pour électrolyser l’eau.4. Structure du liquideLa molécule d’eau est une petite molécule angulaire et symétrique, mais son moment dipolaire élevé (1,85 debye) ne peut être expliqué que par l’existence de deux paires d’électrons libres. Les deux paires et les deux liaisons sont orientées tétraédriquement, comme dans la glace Ih (fig. 2), dans laquelle il y a des liaisons hydrogène (liaisons H) O 漣H...O résultant de l’interaction entre l’hydrogène d’une liaison O 漣H d’une première molécule d’eau et une paire d’électrons libre d’un oxygène d’une autre molécule d’eau.Dès 1933, J. D. Bernal et R. H. Fowler ont proposé un modèle de l’eau liquide fondé sur celui de la glace. Le squelette glace se rompt partiellement en libérant de l’eau monomère dont la proportion croît avec la température. Mais, en 1965, Stevenson a montré que la proportion de monomère était très faible (inférieure à 5 p. 1000 à 25 0C). Cela a conduit H. Eyring à proposer un modèle où des essaims de 48 molécules d’eau ayant la densité de la glace Ih sont dispersés dans un solvant de structure quasi cristalline (densité de la glace III). En fondant, la glace Ih se transforme en liquide quasi cristallin III où apparaissent des lacunes fluctuantes et il y a contraction. Le volume décroît encore à température croissante jusqu’à 3,98 0C, où les derniers essaims du type Ih ont disparu. Au-delà, il y a dilatation normale. Ces concepts introduits dans la théorie des liquides d’Eyring permettent de calculer toutes les fonctions thermodynamiques de l’eau et de l’eau lourde et même les viscosités. L’accord avec l’expérience est excellent.Une théorie différente, fondée sur la notion de squelette à liaisons H distordues mais non rompues, rend compte de la constante diélectrique (J. A. Pople).5. L’eau en tant que solvantL’eau, polaire et de grande constante diélectrique, mauvais solvant des composés non polaires (hydrocarbures), est un bon solvant des composés à liaisons H et des électrolytes.Les solutés non polaires comme l’air, le méthane et l’éthylène sont environ dix mille fois moins solubles que l’ammoniac. Ces composés renforcent la structure cristalline de l’eau par formation d’«icebergs» autour du soluté; l’entropie diminue, ainsi que la solubilité.La solubilité des solutés donnant des liaisons H varie avec le poids relatif de la partie non polaire: l’éthanol est entièrement soluble alors que le butanol ne l’est que partiellement ainsi que le phénol, l’éther et la triméthylamine.La solubilité des protéines et des lipides dans l’eau est faible. La solubilité de l’eau dans ces composés l’est aussi du fait de la compétition entre les liaisons hydrogène, les liaisons molécule-molécule et les liaisons molécule-eau. Les groupes peptidiques peuvent se lier à quatre molécules d’eau, mais il y a encore compétition. On peut comparer à cela le gonflement des résines échangeuses d’ions. Les gels seraient dus à l’adsorption de l’eau à la surface des colloïdes.Les sels, solutés ioniques, ont des solubilités très variées: 360 grammes par kilogramme d’eau pour le chlorure de sodium, 110 grammes pour le sulfate de potassium et seulement 0,7.10-3 g pour le sulfure de zinc. Les ions tels que La3+, Mg2+, H+, OH- et - («formateurs de structures», analogie avec la formation d’«icebergs») servent de noyaux pour la formation d’essaims; il y a accroissement de l’ordre dans l’eau. Les ions comme K+, Na+, Cl4-, I-, 3-, qui sont hydratés par une seule couche de molécules d’eau, inhibent la formation d’essaims: ce sont des «briseurs de structures» (Franck). La mesure de l’hydratation des ions montre que les premiers sont fortement hydratés. En solution diluée, H+ est tétrahydraté (ion H94+ de Eigen). Les solutions concentrées en acide contiennent l’ion H3+; l’ion H+ libre n’existe pas.6. Les hydrates cristallisésL’eau donne d’innombrables hydrates cristallisés à température ambiante que l’on peut diviser en hydrates à eau de coordination, hydrates supérieurs, hydrates de gaz et hydrates labiles.Hydrates de coordination et hydrates supérieursDans la bischofite MgCl2,6 H2O, les molécules d’eau s’orientent octaédriquement autour de l’ion Mg2+ par interaction ion-dipôle, pour former l’ion complexe [Mg(H2O)6]2+. Avec Ni2+, on obtient le même type d’ion, mais l’eau, par effet sur les électrons d de Ni2+, stabilise l’ion formé (effet de ligandes). Dans LiCl4,3 H2O (fig. 3), chaque ion Li+ est entouré d’un antiprisme de six molécules d’eau; il y a des files Li, 3 H2O, Li, 3 H2O et Cl4, Cl4,... parallèles. Dans les hydrates inférieurs, le cation est entouré partiellement d’eau et partiellement d’anions (CuCl2, 4 H2O). Dans les hydrates supérieurs, le cation est entièrement entouré d’eau et des molécules d’eau supplémentaires raccordent par liaisons H le cation hydraté aux anions (NiSO4, 7 H2O). Dans les hydrates d’acides forts, l’eau est coordinée au proton (ions H3+ et H52+ du monohydrate et du dihydrate de l’acide perchlorique). L’acide oxalique, faible, donne un dihydrate par liaisons hydrogène.Hydrates de gaz et anesthésieL’eau donne des hydrates avec les gaz argon, méthane, hémioxyde d’azote, dioxyde de carbone, etc. L’hydrate de chlore dit à 6 molécules d’eau qui en est le prototype est en réalité à 5,75 H2O. L’eau y prend une configuration spéciale et forme des cages qui piègent les petites molécules: 46 H2O groupées piègent 8 Cl2 ou 8 Ar, etc., 136 H2O groupées autrement piègent 16 molécules de chloroforme (hydrates à 17 H2O, fig. 3). Linus Pauling a expliqué l’action anesthésique de composés tels que l’oxyde nitreux, le dioxyde de carbone et le chloroforme ainsi que des gaz rares (agents non formateurs de liaisons H) par la cristallisation de leurs hydrates. Les microcristaux formés abaissent la conductivité électrique du réseau nerveux. Il y a diminution concomitante de l’énergie des oscillations électriques qui caractérisent l’état conscient et, de ce fait, perte de connaissance. C’est aussi de cette façon que l’on pourrait expliquer l’hibernation (formation de cristaux d’hydrates de gaz par diminution de la température).Hydrates labilesLes permutites et zéolites naturels ou artificiels, échangeurs d’ions minéraux et tamis moléculaires, forment des cages dans lesquelles l’eau est piégée. Ce sont des alumino-silicates. Le zéolite «A» Na12[(AlO2)12(SiO2)12] peut capter 27 H2O qu’il perd progressivement quand la température augmente.
Encyclopédie Universelle. 2012.
